
Долженко М. М., доктор медичних наук, професор, заслужений лікар України, завідувач кафедри кардіології НУОЗ імені П.Л.Шупика.
Лучинська Ю.О., к.мед.н, асистент кафедри кардіології НУОЗ імені П.Л.Шупика.
Ключові слова: мелатонін; безсоння; регулювання циклу сон-неспання; порушення сну; антигіпертензивний засіб; артеріальна гіпертензія; нічна гіпертензія.
Резюме. Незважаючи на великі досягнення в області лікування гіпертонії в усьому світі залишається актуальним дотримання режиму лікування та задовільний контроль артеріального тиску (АТ). В результаті, кардіологи невпинно шукають нові засоби контролю АТ. Є докази того, що мелатонін може мати гіпотензивну дію і потенційне використання його в лікуванні гіпертонії викликає підвищену зацікавленість. Цей огляд зосереджений на мелатоніні, його ролі в серцево-судинній системі та перспективах його використання як допоміжного антигіпертензивного засобу.
Гормон мелатонін (N-ацетил-5-метокситриптаміну) (Мал. 1) - індоламін який має дві основні властивості: (1) є амфіфільним (коефіцієнт розподілу 1,2), майже однаково дифундує у водному та ліпідному середовищі що обумовлює його розподіл по всім тканинам організму, і (2) є потужною антиоксидантною молекулою, яка ефективно поглинає майже будь-який кисень і азот [13–16,18,61].

Мал. 1. Хімічна формула мелатоніна
Мелатонін виконує свою традиційну роль як хронобіотик або ендогенний синхронізатор, що регулює сезонні та циркадні ритми, а також стимулює сон-ефекти [13,16]. Він виробляється епіфізом за нормальних фізіологічних умов, при активації супрахіазматичного ядра гіпоталамуса вночі (у відповідь на слабке освітлення) [13–16,18]. Інформація, пов’язана з довжиною хвилі та інтенсивністю світла, сприймається сітківкою, передається в SCN і далі в епіфіз, де вона контролює вироблення мелатоніну з точки зору підвищення секреції мелатоніну в темний час доби [13–16,18,61]. У мелатоніна є протилежний гормон – кортизол. Він є глюкокортикоїдним гормоном, що також приймає участь у регулюванні циркадних ритмів, і вважається є гормоном стресу. Кортизол - основний кінцевий продукт гіпоталамо-гіпофізарно-надниркової системи. Його активація також відбувається у супрахіазмальному ядрі гіпоталамуса але під дією світла. Коли рівень мелатоніну підвищується вночі, рівень кортизолу є найнижчим, а коли рівень кортизолу піднімається до найвищого вранці, рівень мелатоніну падає до найнижчого рівня. І дисбаланс рівня мелатоніну так і ритму вироблення кортизолу призводить до проблем зі сном. [106].
Концентрація мелатоніну залишається постійною протягом дня, але швидко зростає між 2 - 4 годиною ночі досягаючи короткочасного піку
(42-75/100 пг/мл), а потім поступово зменшується до настання світла, щоб повернутися до добового рівня (1-3 пг/мл) [ 2,35,36,75 ]. Вважається, що на вироблення мелатоніну впливають різні фактори, такі як: вік, стать, сезон та деякі захворювання. Його рівень зменшується з віком - у жінок похилого віку він вищий, ніж у чоловіків, а вироблення взимку вище, ніж влітку [2, 37 ].
Мелатонін взаємодіє в основному через три типи високоафінних рецепторів, пов’язаних з G-білком: тип 1 (ML1 або Mel 1a), тип 2 (ML2 або Mel 1b) та тип 3 ( ML3). Активація мелатонінових рецепторів пов'язана з інгібуванням аденідатциклази та зменшенням внутрішньоклітинного рівня цАМФ. Рецептори тип 3 є ядерними ділянками зв'язування мелатоніну, що знаходиться в цитозолі і відповідають за детоксикацію шкідливих агентів [20]. Взаємодія мелатоніну через мембранні рецептори тип 1 і тип 2 є потенційними терапевтичними цілями починаючи від безсоння, циркадних розладів сну, депресії та серцево-судинних захворювань [13,16,17,22,25]. Рецептори мелатоніну були ідентифіковані в багатьох фізіологічних системах, включаючи: нервову, серцево-судинну, імунну, репродуктивну та ендокринну системи. Крім того, рецептори наявні в шлунково-кишковому тракті, шкірі, сітківці ока, печінці та нирках, що робить потенційний вплив мелатоніну справді системним [6-12,18]. (Мал. 2).
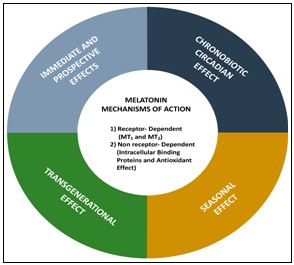
Мал. 2. Механізм дії мелатоніну [61].
Мелатонін, як багатофункціональна молекула, безпосередньо приймає участь у численних біологічних процесах та володіє: антивіковою, протизапальною, імуномодулюючою, вазомоторною, репаративною та метаболічою властивостями, що регулюють енергетичний, глікемічний і ліпідний обмін [2,13,16, 22-26,61,75]. Широкі антиоксидантні ефекти мелатоніну добре відомі. Цей індолеамін обмежує окислювальний стрес як позаклітинно, так і внутрішньоклітинно за допомогою різноманітних механізмів, таких як пряме видалення радикалів, стимуляція активності та експресії антиоксидантних ферментів, підтримка синтезу та рециркуляції глутатіону, захист інших антиоксидантів та зниження активності прооксидантних ферментів. Онкостатичні ефекти мелатоніну можливі завдяки здатності впливати на клітинний метаболізм, апоптоз, міжклітинну комунікацію, ангіогенез та мітохондріальну активність [2, 16, 42].
Мелатонін також покращує мітохондріальний транспорт електронів і приріст енергії, а також модифікує запалення і апоптоз. Ці субклітинні захисні дії мелатоніну призводять до ряду потенційно корисних дій у різних системах, включаючи ефект зниження АТ [ 80 ].
У серцево-судинній системі людини рецептори мелатоніну присутні в церебральних артеріях, коронарних артеріях, аорті, стінці серцевого шлуночка та системних артеріях [19]. Враховуючи широке поширення рецепторів у серцево-судинній системі людини, не дивно, що недостатність мелатоніну має значення при серцево-судинних захворюваннях [18].
Мелатонін взаємодіє із серцем і судинами опосередковано через нервову систему та гормон взаємодію [19,22,24], так і безпосередньо, через його рецептор-залежну та незалежну діяльність як сигнальна молекула та поглинач вільних радикалів [25,27]. Саме здатність мелатоніну до поглинання вільних радикалів (за рахунок взаємодії з кількома активними формами кисню) та регуляцію транскрипції генів для антиоксидантних ферментів пов»язують його кардіопротекторні властивості [17,13 ].
Кардіопротективна роль сну
Протягом багатьох років роль сну в патофізіології людини була об'єктом уваги майже виключно психологів і неврологів, але останнім часом концепція сну як відновного процесу в більш широкому розумінні стала поширюватись на фізіологічні функції всього організму.
Безсоння, що визначається як труднощі з ініціюванням / підтримкою сну або сну без відновлення, пов’язане зі значним денним дистресом (Діагностичний та статистичний посібник із психічних розладів, 4-е видання [DSM-IV]) зустрічається приблизно у 30% суб’єктів у віці 55 років і старше [ 84,85].
Зокрема, безсоння є найпоширенішим розладом сну, яке спостерігається приблизно у третини людей у загальній популяції в Європі [ 53 ]. Приблизно від 6% до 10% дорослих мають безсоння в Сполучених Штатах та частіше зустрічається у жінок і літніх людей, може виникати самостійно або бути викликано іншим захворюванням [74]. В результаті багаточисельних досліджень виявлена висока коморбідність інсомнії з різними захворюваннями, зокрема з метаболічними, серцево-судинними та неврологічними, ризиком розвитку раку, розладами настрою і погіршенням самопочуття в цілому [43,54] (Мал. 3).
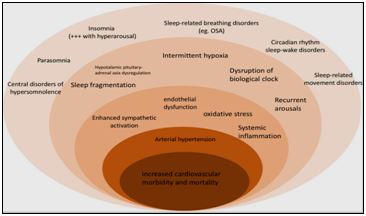
Мал. 3. Основні механізми зв’язку між порушеннями сну та підвищенням серцево-судинної захворюваності та смертності. OSA - обструктивне апное сну [ 52 ].
Однією з головних проблем зі здоров’ям у людей старше 55 45 старшого віку є гіпертонія [ 53,54]. Поширеність гіпертонії значно вища серед пацієнтів з безсонням (~44%) порівняно з тими, хто добре спить (~19%), що свідчить про перехресну взаємодію між сном і контролем АТ [84]. Крім того, було виявлено, що короткий сон і безсоння є факторами ризику гіпертонії (було оцінено у пацієнтів середнього віку та пацієнтів із депресією) [86,87]. У літніх людей було показано, що порушення структури сну підвищує ризик розвитку гіпертонії [88]. Відповідно, нещодавнє когортне дослідження в Голландії за участю 20 432 чоловіків і жінок у віці 20–65 років показало, що у тих, хто має короткий сон з поганою якістю сну, ризик серцево-судинних захворювань вищий на 63% і ризик ішемічної хвороби серця вищий на 79% порівняно із суб'єктами з хорошою якістю сну [83,89].
У дослідженні Taylor et al .[44] продемонстрували, що люди з хронічним безсонням, у порівнянні з когортою без порушення сну, більше повідомляли про: захворювання серця (21,9% проти 9,5%), високий артеріальний тиск (43,1% проти 18,7%), неврологічні захворювання (7,3% проти 1,2%) ), проблеми з диханням (24,8% проти 5,7%), проблеми з сечовипусканням (19,7% проти 9,5%), хронічний біль (50,4% проти 18,2%) та проблеми з шлунково-кишковим трактом (33,6% проти 9,2%) [44].
Обсерваційні дослідження та експериментальні дані повністю підтверджують існування тісного зв’язку між порушеннями сну та артеріальною гіпертензією, серцево-судинними захворюваннями, цукровим діабетом та/або ожирінням [43,45,46,52]. Безсоння пов’язують із збільшенням маркерів системного запалення - відомого фактора ризику гіпертонії та діабету [60]. Крім того, у пацієнтів з безсонням спостерігається збільшення частоти серцевих скорочень і хронічна активація системи гіпоталамус–гіпофіз–наднирники, які були пов’язані з метаболічними порушеннями, такими як цукровий діабет [60].
Серед розладів сну, що впливають на артеріальний тиск (АТ) обструктивне апное сну асоціюється з підвищеним ризиком виникнення гіпертензії та резистентності до лікування, а також порушенням нічного фізіологічного зниження АТ і, зараз, визнано як один із модифікованих обтяжуючих факторів глобального серцево-судинного ризику [56]. Відстрочення настання сну також збільшує ймовірність розвитку гіпертензії, з оцінкою ризику в 300% (відношення шансів 3,27; 95% довірчий інтервал 1,20–8,96). У жінок нестача сну може бути особливою причиною вразливості до гіпертонії та серцево-судинних подій [ 57, 58]. Паралельно був описаний U-подібний зв’язок між тривалістю сну та смертністю від усіх причин, а також підвищеним серцево-судинним ризиком [59] .
Зв'язок між короткою тривалістю сну та гіпертонією виявляється найбільш значущим у середньому віці. Коротка тривалість сну спрогнозувала збільшення ймовірності виникнення гіпертонії (OR, 1,37; 95% ДІ, 1,05-1,78). Кожна година скорочення сну була пов’язана з підвищенням на 37% ймовірності розвитку гіпертонії [66].
Поперечний аналіз, проведений на 32 152 суб’єктах показав, що серед пацієнтів як із короткою (меньше 6-7 годин) так і довгою (більше 8- 9 годин) тривалістю сну вища частота клінічних історій церебрального інсульту і серцевої недостатності [54]. У мета-аналізі [57], що включив 15 досліджень і 474 684 суб’єктів, проаналізували зв’язок між тривалістю сну та довгостроковим ризиком серцево-судинних подій з тривалістю спостереження 6,9–25 років. Встановлено підвищений ризик розвитку гіпертензії, ожиріння, цукрового діабету, серцевої недостатності та інсульту (фатального та нефатального) як у суб'єктів з короткою так і довгою тривалістю сну (Таблиця 1).

Таблиця 1. Зв'язок між тривалістю сну, детермінантами серцево-судинного ризику та серцево-судинними подіями [ 52 ]. Стрілки вгору/вниз вказують на підвищений/знижений ризик відносного стану, тоді як знак рівності вказує схожий ризик порівняно з проміжною тривалістю сну. Однакова кількість стрілок вказує на відсутність різниці в ризику між короткою та довгою тривалістю сну. Знаки питання - суперечливі докази.
Враховуючи вище скзане, важливо виявляти порушення сну у пацієнтів з резистентною артеріальною гіпертензією та втратою фізіологічного нічного зниження АТ та/або підвищеним серцево-судинним та/або метаболічним ризиком. Відповідно, виникає необхідність багатовимірного підходу до гіпертензії, який включає впровадження зміну способу життя (дієта, фізичні вправи, схуднення) і застосування ліків, в тому числі для відновлення сну [4].
На сьогодні спектр препаратів, які застосовують у терапії порушень сну включає: агоністи бензодіазепінових рецепторів, блокатори Н1-гістамінових рецепторів, антидепресанти, седативні препарати та мелатонін. Кожна група препаратів має певні особливості, а побічні ефекти часто стають перепоною для їх призначення та тривалого застосування [1]. Частіше всього серед побічних ефектів снодійних препаратів зустрічаються: денна сонливість, запаморочення, зниження концентрації уваги, погіршення координації (збільшується частота падінь та переломів), зниження розумової та фізичної працездатності, м»язова слабкість, алергічні реакції, збудження, галюцинація, диспептичні явища. Часто при повторному прийомі снодійних препаратів до них виникає звикання, а також можливий розвиток залежність (психічної та фізичної) [68]. Нещодавні дослідження також виявили потенційний підвищений ризик хвороби Альцгеймера, раку та смертності після тривалого вживання снодійних препаратів [71].
Загальне вироблення мелатоніну у здорових людей похилого віку протягом 24 годин, схоже, не змінюється, але нічний пік концентрації зменшується [69,77]. Таким чином, лікування літніх людей мелатоніном може покращити сон та якість життя [76]. Результати проведених досліджень вказуюь на те, що додаткові препарати мелатоніну з контрольованим і пролонгованим вивільненням (PRM) для антигіпертензивної терапії покращують нічну гіпертензію [83]. Тому важливо з’ясувати, чи будуть такі препарати ефективно лікувати безсоння у пацієнтів із серцево-судинними захворюваннями.
Мелатонін є найбільш безпечним снодійним препаратом з іншим механізмом дії, який безпосередньо впливає на цикл сон/неспання та зумовлює фізіологічний сон. Мелатонін має важливу особливість, що надзвичайно актуальна для пацієнтів похилого віку та хворих на артеріальну гіпертензію - зберігає та відновлює природну структуру сну і під час його дії не відбувається пригнічення повільнохвильового глибокого сну, який є найбільш відновлювальним і вкрай важливим для контролю АТ та регуляції вуглеводного обміну [69,70].
У молодих людей дисбаланс синтезу гормону мелатоніна частіше виникає на фоні стресових ситуацій, а також порушеня циркадних біологічних ритмів (десинхроноз): зміна часових поясів під час авіаперельотів (синдром jet lag), позмінна робота в нічні години, безперервна робота за комп»ютером перед сном та вночі (при цьому продукція мелатоніна може знижуватись майже на 20%) [70]. Десинхроноз викликає порушення сну, травлення, зниженням фізичної та розумової працездатності, може стати причиною емоційної нестабільності ( у важких випадках - привести до неврозу), привести до захворювань серцево-судинної, ендокринної та репродуктивної системи [70]. Гіпнотичні та ритморегулюючі властивості мелатоніну та його агоністів (рамелтеон, агомелатин) можуть зробити їх важливим доповненням до набору препаратів для лікування первинного та вторинного безсоння та розладів циркадного ритму сну [13].
Мелатонін 2 мг схвалено для лікування первинного безсоння у пацієнтів віком ≥ 55 років в окремих країнах (Італія) [73]. Пацієнти можуть отримувати лікування мелатоніном до 13 тижнів. Прийом мелатоніну PR 2 мг за 1–2 години перед сном імітує природну секрецію мелатоніну та призводить до покращення циркадної регуляції циклу сон/неспання. У літніх людей прийом додаткового мелатоніну не впливає на психомоторні функції, запам’ятовування або навички водіння у порівнянні з золпідемом 10 мг окремо або в комбінації з мелатоніну PR 2 мг. Профіль переносимості мелатонін PR був подібним до плацебо, а також не було виявлено залежністі, розвитку толерантності, безсоння або симптомів відміни [11]. Також були проналізовані небажані побічні ефекти при прийомі мелатоніну: вчені дійшли висновку, що мелатонін є безпечним препаратом [63,64,72].
Пероральний мелатонін можна вводити в різних дозах залежно від захворювання, яке ми лікуємо (зазвичай від 0,5 до 5 мг перед сном). Ключовим елементом є час прийому, який має бути регулярним і вибиратися на основі особливостей розладу сну [52,62].
Синтетичний мелатонін є дієтичною добавкою. FDA (The United States Food and Drug Administration) не регулює харчові добавки так як вони вважаються безпечними, тому мелатонін офіційно не схвалений для будь-яких показань. Однак на ринку є різні агоністи рецепторів мелатоніну, такі як рамелтеон і тасимелтеон, які схвалені FDA для лікування безсоння [92,93]. Незважаючи на відсутність схвалення FDA, мелатонін вважається фармакологічним засобом першої лінії для лікування безсоння Американською академією сімейних лікарів (AAFP). Мелатонін відносно нетоксичний, хоча повідомлялося про деякі слабкі побічні ефекти при застосуванні вищих доз і препаратів з пролонгованим вивільненням, включаючи: сонливість, головний біль та нудоту [91]. Також слід зазначити, що відсутність регулювання з боку FDA може викликати занепокоєння щодо фактичних концентрацій мелатоніну у добавках. В одному дослідженні проаналізували 31 добавку мелатоніну і виявили, що фактичний вміст мелатоніну коливається від -83% до +478% від зазначеного виробником [94]. Змінний вміст таблеток може ускладнити точне дозування і впливати на ефективність. Одним із способів забезпечити правильне дозування є пошук харчових добавок схвалених незалежною неприбутковою організацією United States Pharmacopeia. Пошук добавок з позначкою «USP verified» може допомогти забезпечити якість і дозування добавок [94].
Слід зазначити, що лікування мелатоніном є високоефективним, поліпшує якість сну, не впливає на рівень бадьорості наступного дня та покращє якість життя. На підставі отриманих результатів з доведеним високим профілем безпечності та гарною переносністю, Європейська агенція з лікарських засобів [95], Британська асоціація психофармакології [96] та Італійське науковие товариство [97]схвалили мелатонін як препарат першої лінії вибору при лікуванні первинної інсомнії у пацієнтів віком понад 55 років [63]. А Європейське управління з безпеки харчових продуктів дозволило застосування мелатоніну (0,5 - 5,0 мг) для терапії синдрому jet lag, що зменшує час адптації на 50 % [79].
Чи доцільно призначати мелатонін при артеріальній гіпертензії?
Резистентна до лікування артеріальна гіпертензія часто містить центральний нейрогенний патологічний компонент, а вищезазначені механізми дії мелатоніну можуть знайти своє застосування в його лікуванні. При дослідженні мелатоніну крім зниження АТ виявлені симпатолітичні та брадикардичні ефекти та завдяки його очевидній антипроліферативній дії, цей гормон навіть забезпечує нефро- та кардіопротекцію. Таким чином, мелатонін стає важливим кандидатом для дослідження в сфері лікування резистентної гіпертензії [81,82, 61].
Зниження середнього нічного АТ (як систолічного, так і діастолічного) на 10 –20 % порівняно із середнім денним вважається нормальним [33]. Відсутність нічного зниження АТ (non-dipping) пов’язано зі збільшенням пошкодження кінцевих органів-мішеней: гіпертрофією лівого шлуночка, дисфункцією нирок, цереброваскулярними захворюваннями і є незалежним предиктором серцево-судинних подій. У дослідженні Ohasama зазначено, що в середньому кожен 5% дефіцит нормального зниження нічного АТ був пов’язаний приблизно із 20% ризиком серцево-судинної смертності [65]. Експерементальним шляхом встановлено, що пацієнти групи non-dipping мають нижчий рівень мелатоніну [78]. Попередні дані продемонстрували меншу продукцію, секрецію та системний рівень мелатоніну у пацієнтів хворих на артеріальну гіпертензію [21,34]. Obayashi et al також повідомляли що у літніх гіпертоніків нічне падіння систолічного артеріального тиску було значно вищим у осіб з більшою екскрецією мелатоніну [65].
Завдяки системному розподілу мелатоніну та поширеній локалізації його рецепторів у центральній та периферичній серцево-судинній та нервовій системах, не дивно, що нещодавні дослідження висвітлюють ключову роль мелатоніну в регуляції саме АТ. Нічні концентрації мелатоніну, які вищі за денні, зазвичай знижують кров’яний тиск. Завдяки своїм антиоксидантним і антипроліферативним ефектам [82] мелатонін може покращити ендотелій-залежне розширення артеріол та впливати на гладку мускулатуру артеріол, що призводить до зниження периферичного судинного опору [13,38,39,61,82].
Вплив мелатоніну на вазодилатацію відбувається двома основними шляхами: прямим блокуванням кальцієвих каналів і опосередковано через ендотелійзалежне підвищення оксиду азоту (NO) і цГМФ (Мал. 4). Механізм ендотелій-залежної вазодилатації починається з активації рецептора МТ2 на ендотеліальних клітинах для ініціації каскаду сигналів, який включає: збільшення внутрішньоклітинного кальцію для стимуляції шляхів ендотеліальної NO синтази, що, у свою чергу, збільшує продукцію NO. Власне оксид азоту додатково активує цитозольну гуанілатциклазу і підвищує цГМФ в гладких м’язах судин, тим самим завершує цикл [78]. Результатом цих взаємодій відбувається інгібування вазодилатації або вазоконстрикція. Одне з пояснень полягає в тому, що мелатонін опосередковує дві протилежні реакції в гладком’язових клітинах судин, які залежать від концентрації мелатоніну. При більш низьких концентраціях мелатонін посилює скорочення, тоді як при вищій концентрації скорочення послаблюються [98]. Це може пояснити природне падіння АТ, яке відбувається протягом ночі, коли концентрація мелатоніну висока. Satake et al продемонстрували інгібуючу дію мелатоніну, подібну до дії верапамілу, та припустили, що мелатонін має характеристики, подібні до блокаторів кальцієвих каналів для послаблення вазоконстрикції [78].
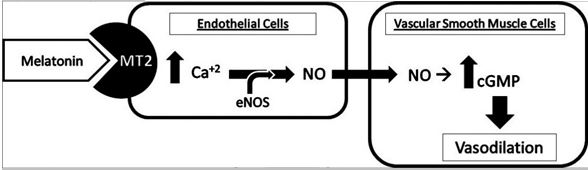
Мал. 4. Механізм ендотелій-залежної вазодилатації, опосередкованої через мелатонін. Ca2+ кальцій; eNOS - ендотеліальна NO синтаза; цГМФ - циклічний гуанозинмонофосфат; MT2- рецептор мелатоніну 2 типу; NO - оксид азоту [78].
У проведених дослідженнях низькі дози мелатоніну (1 мг) як у здорових чоловіків, так і у жінок викликали значне зниження систолічного, діастолічного та середнього АТ, значно знижували рівні норадреналіну та індекс пульсації внутрішньої сонної артерії - пряме відображення імпедансу кровотоку, що свідчить про звуження судин. [78].
Окислювальний стрес бере участь у багатьох патофізіологічних станах і тісно пов’язаний з гіпертонією. Активні форми кисню і азоту можуть спричинити пошкодження ДНК і мати потенційно шкідливий вплив на функцію та цілісність клітин. Системи антиоксидантного захисту допомагають обмежити шкоду, яка виникає в результаті окисного стресу і вільних радикалів. Мелатонін та його метаболіти є потужними антиоксидантами та поглиначами вільних радикалів здатних прямо або опосередковано знижувати окислювальний стрес. Мелатонін поглинає кілька реактивних агентів, що отримують кисень, включаючи гідроксильні радикали, перекис водню, синглетний кисень і хлорну кислоту. Мелатонін також може реагувати з аніоном пероксинітриту та/або пероксинітритною кислотою для їх детоксикації [100]. Цікавість до мелатоніну збільшується завдяки його структурі: він є амфіфільною молекулою, і тому може викликати антиоксидантну дію як у ліпідному, так і у водному середовищі. Такі ферменти, як каталаза, супероксиддисмутаза і глутатіонпероксидаза допомагають обмежити утворення вільних радикалів і нейтралізувати ті, що утворилися. У моделях з гіпертензією, а також у популяціях з клінічною гіпертензією, де показано, що резерви антиоксидантів знижені, введення мелатоніну значно підвищує їх рівні [101,102]. Крім того, покращення цих антиоксидантних захисних властивостей у результаті прийому мелатоніну також пов’язують із зниженням АТ та пригніченням реакції на різні скоротливі агенти, включаючи фенілефрин та норадреналін [102]. У дослідженнях 2 мг перорального мелатоніну значно знижували рівень норадреналіну і дофаміну в плазмі та АТ лежачи та підвищували парасимпатичні параметри варіабельності серцевого ритму [103].
Також є вагомі докази на підтримку центральних вегетативних механізмів, що опосередковують гіпотензивний вплив мелатоніну. Відомо, що нічна гіпертензія пов’язана з підвищеною симпатичною активацією, підвищенням рівня оксиду азоту, симпато-вагусним дисбалансом та зниженою продукцією та секрецією мелатоніну [104]. На сьогодні відомо, що одним з ефектів мелатоніну є здатність до пригніченням симпатичної системи, а також можлива стимуляція парасимпатичної активності. [78]. У дослідженнях введення мелатоніну збільшувало парасимпатичні параметри варіабельності серцевого ритму, включаючи інтервал RR, середню квадратичну величину послідовних різниць (RMSSD) і високу частоту, а також зменшувало співвідношення низької частоти: високої частоти та артеріального тиску в положенні лежачи. [ 105 ].
Відновлення правильної функції мелатонінової системи — наприклад, шляхом перорального прийому мелатоніну — може сприяти відновленню сну та кардіометаболічному захисту. Гіпертонія з циркадними змінами артеріального тиску є частою причиною серцевих ускладнень, та була досліджена як потенційна терапевтична мішень для мелатоніну [62,63],
На сьогодні отримані результати декількох досліджень з вивчення впливу мелатоніну на рівень АТ:
У 16 чоловіків із нелікованою есенціальною гіпертензією досліджували вплив гострого (одноразового) та повторного (щодня протягом 3 тижнів) перорального прийому мелатоніну (2,5 мг) за 1 годину до сну. Одноразова доза мелатоніну не впливала на АТ, проте багаторазове вживання мелатоніну перед сном знижувало нічний АТ та покращувало сон. Покращення АТ і сну статистично не пов’язані [26].
В дослідженні Cagnacci та його колег описаний вплив 3-тижневого введення мелатоніну перед сном на АТ у жінок. Вони досліджували 9 жінок з нормальним тиском і 9 жінок з есенціальною гіпертензією, яка контролювалася інгібіторами ангіотензин-перетворюючого ферменту. Вони виявили зниження АТ вночі в об’єднаній групі з 18 жінок середнього віку [33].
У нещодавньому мета-аналізі подвійних сліпих плацебо-контрольованих РКД, за участі 221 чоловіка, які отримували мелатонін в дозі 2–5 мг на добу протягом 7–90 днів. Мелатонін викликав значне зниження систолічного АТ вночі [–6,1 (95% ДІ –10,7, –1,5) мм рт.ст.; P = 0,009] і нічного діастолічного АТ [–3,5 (95% ДІ –6,1, –0,9) мм рт.ст.; п= 0,009] Крім того, оскільки β-блокатори пригнічують секрецію мелатоніну, прийом добавок мелатоніну покращував сон у пацієнтів з артеріальною гіпертензією, які лікуються β-блокаторами [22,23,90].
Досліджння з вивчення можливого впливу тривалого нічного прийому мелатоніну на добовий ритм АТ включало 18 жінок: із нормальним АТ (N = 9) або есенціальною гіпертензією (N = 9), які отримували 3-тижневий курс мелатоніну (таблетки по 3 мг або плацебо за 1 год до сну). У порівнянні із плацебо, введення мелатоніну не впливало на добовий АТ, але значно знижувало нічний систолічний (-3,77 +/- 1,7 мм рт.ст., P = 0,0423), діастолічний (-3,63 +/- 1,3 мм рт.ст., P = . 0153) і середній АТ (-3,71 +/- 1,3 мм рт.ст., P = 0,013) без зміни частоти серцевих скорочень. Ефект був обернено пов’язаний з різницею АТ день-ніч. Тобто, тривале застосування мелатоніну може покращити денно-нічний ритм АТ, особливо у жінок із недостатнім нічним зниженням [33].
Також проведено дослідження 38 пацієнтів з гіпертонічною хворобою та підтвердженою нічною гіпертензією, що отримували 2 мг мелатоніну з контрольованим вивільненням (CR) або плацебо за 2 години до сну протягом 4 тижнів. Отримані результати показали значне зменшення нічного систолічного АТ з 136+/-9 до 130+/-10 мм рт.ст. (P=.011), а діастолічного АТ з 72+/-11 до 69+/-9 мм рт.ст. (P= 0,002), тоді як плацебо не впливало на нічний АТ. Зниження нічного систолічного АТ було найбільш помітним між 2:00 ранку та 5:00 ранку (P=0,002) [40].
В іншому дослідженні мелатонін вводили перорально, і його ефект порівнювали з плацебо у здорових чоловіків. Поряд зі зниженням рівня катехоламінів у групі мелатоніну було показано значне зниження АТ. Крім цих знахідок, був знижений індекс пульсації у внутрішній сонній артерії [25].
Проведене спостереження у 21 пацієнта з артеріальною гіпертензією II стадії (середній вік 62 роки) з вивчення фективності монотерапії Cozaar (50 мг о 8 ранку) порівнювали з комбінованою терапією Cozaar з мелатоніном (3 мг перед сном). Комбінація Cozaar + мелатонін більш помітно знижувала АТ та серцевий викид, енергоспоживання міокарда, продемонструвала нормалізацію хроноструктури АТ та циркадних ритмів серцевого ритму [109].
Проведена оцінка ефективності та безпеки мелатоніну з пролонгованим вивільненням при первинному безсонні у 412 пацієнтів віком 55 років і старше, які отримували антигіпертензивну терапію (β-блокатори, інгібітори ренін-ангіотензинової системи та блокатори кальцієвих каналів). Було встановлено, що додавання мелатоніна з пролонгованим вивільненням до антигіпертензивної терапії зменшує нічну гіпертензію [83].
Мелатонін є основним циркадним гормоном який зазвичай призначається при безсонні, але встановлено, що при зниження вироблення та секреції мелатоніну тісно пов’язане з розвитком гіпертонії. Екзогенний мелатонін є більш ефективним для сприяння сну за наявності зниженого виробництва ендогенного мелатоніну, а також все більша кількість емпіричних даних починає визнавати мелатонін як потенційно ефективний допоміжний антигіпертензивний засіб. На сьогоднішній день мелатонін вже показав перспективи в клінічних популяціях есенціальної та нічної гіпертензії, однак поки це не дозволяє замінити стандартний терапевтичний підхід лікування артеріальної гіпертензії. Отримані результати визначають необхідність подальшого проведення широкомасштабних довгострокових клінічних дослідженнях фази 2b та 3.
Мелатонін традиційно призначається перорально, при цьому його біодоступність знижується [108]. Проведено огляд 10 клінічних досліджень з вивчення фармакокінетики альтернативних шляхів введення мелатоніну in vivo. В результаті зазначено, що сублінгвальне застосування через слизову оболонку потенційно може мати клінічне значення через уникнення метаболізму першого проходження [107].
На ринку України сублінгвальна форма мелатоніна (3 мг) представлена препаратом «Мелафреш» («Прайм Хелс ЛТД», Канада), що не є лікарським засобом. Зазвичай його приймають 1 раз на день суворо дотримуючись певного часу, сублінгвально, за 30 хвилин до можливого сну. Його не слід приймати, якщо передбачувана тривалість сну меньше 6-8 годин, вагітним, або жінкам, що планують вагітність, маленьким дітям. Рекомендується бути обережними, якщо в анамнезі цукровий діабет, алкогольна залежність, захворювання печінки, фенілкетонурія та остерігатись сумісного прийому із речовинами, що викликають сонливість (антидепресантами, антипсихотичними та наркотичними препаратами).
Клінічний випадок із власного досвіду. На прийом звернулась жінка 57 років, із скаргами на дестабілізацію цифр АТ в нічний час за останній рік, а також труднощі засинання, часті нічні пробудження (переривчастий сон), втому і розбитість протягом дня. Хворіє на АГ протягом 6 років (після настання менопаузи), постійно не лікувалась, але декілька місяців приймає щодня периндоприл 5 мг в комбінації з індапамідом 1,25 мг 1 раз на добу. Із слів, на фоні лікування денний профіль АТ покращівся (цифри АТ коливаються в межах 135-138 / 80-83 мм рт. ст.), але відмічає почастішання випадків підвищенння АТ вночі (максимум 150/90 мм рт. ст.). Проведено амбулаторне моніторування АТ де оцінений профіль добових змін як non dipper. До призначеного попередньо лікування рекомендовано додати «Мелафреш» 3 мг 1 раз на добу за 30 хвилин до передбачуваного настання сну на 3 тижні. Під час наступного візиту пацієнтка відзначила кращій профіль АТ протягом доби (згідно щоденника самоконтролю рівень АТ протягом дня не перевищував 130/ 80-82 мм рт. ст.), за 3 тижні був лише 1 епізод підвищення нічного рівня АТ до 140/90 мм рт.ст. Також відмітила усунення проблеми засинання і вкрай рідкі пробудження вночі за цей період, що значно покращіло її самопочуття вдень. Під час проведення контрольного моніторування АТ оцінений профіль добових змін як dipper. Також жінка не відмічала появу будь-яких побічних ефектів.
Слід зазначити, що «Мелафреш»:
є безрецептурним препаратом
сублінгвальна форма підвищує його біодоступність та концентрацію в крові
надає м»який седативний ефект який зумовлює фізіологічний сон
підтримує та відновлює природну структуру сну, чергування фаз та їх тривалість (чим більш виражене порушення сну, тим виразніше відповідь)
покращує денно-нічний ритм АТ
зменшує нічну гіпертензію при поєднанні із традиційними антигіпертензивними препаратами
не має токсичних побічних ефектів та є безпечним препаратом для клінічного застосування
відсутнє звикання та синдром відміни
простий у застосуванні
Препарат «Мелафреш» можна розглядати як засіб першої лінії при розладах сну, в тому числі пов’язаних із десинхронозом, а також для корекції артеріальної гіпертензії при поєднанні із традиційними антигіпертензивними препаратами.
Література:
Оковитый С. В., Титович И. А. Фармакологические принципы терапии инсомнии // Медицинский совет. — 2018. — № 6. — С. 26 — 32.
doi: 10.21518/2079-701X-2018-6-26-32
Пішак В. П. Шишкоподібне тіло і біохімічні основи адаптації //
Чернівці: Медакадемія, 2003. — 152 с\
Gögenur I, Kücükakin B, Panduro Jensen L, Reiter RJ, Rosenberg J. Melatonin reduces cardiac morbidity and markers of myocardial ischemia after elective abdominal aortic aneurism repair: a randomized, placebo-controlled, clinical trial. J Pineal Res. (2014) 57:10–5. doi: 10.1111/jpi.12138
Ghaeli P, Vejdani S, Ariamanesh A, HajhosseinTalasaz A. Effect of melatonin on cardiac injury after primary percutaneous coronary intervention: a randomized controlled trial. Iran J Pharm Res. (2015) 14:851–5.
Dwaich KH, Al-Amran FG, Al-Sheibani BI, Al-Aubaidy HA. Melatonin effects on myocardial ischemia-reperfusion injury: impact on the outcome in patients undergoing coronary artery bypass grafting surgery. Int J Cardiol. (2016) 221:977–86. doi: 10.1016/j.ijcard.2016.07.108
Ekeloef S, Halladin N, Fonnes S, Jensen SE, Zaremba T, Rosenberg J, et al. Effect of intracoronary and intravenous melatonin on myocardial salvage index in patients with ST-elevation myocardial infarction: a randomized placebo controlled trial. J Cardiovasc Transl Res. (2017) 10:470–9. doi: 10.1007/s12265-017-9768-7
Dominguez-Rodriguez A, Abreu-Gonzalez P, de la Torre-Hernandez JM, Consuegra-Sanchez L, Piccolo R, Gonzalez-Gonzalez J, et al. Usefulness of early treatment with melatonin to reduce infarct size in patients with ST-segment elevation myocardial infarction receiving percutaneous coronary intervention (from the melatonin adjunct in the acute myocardial infarction treated with angioplasty trial). Am J Cardiol. (2017) 120:522–6. doi: 10.1016/j.amjcard.2017.05.018
Dwaich KH, Al-Amran FG, Al-Sheibani BI, Al-Aubaidy HA. Melatonin effects on myocardial ischemia-reperfusion injury: impact on the outcome in patients undergoing coronary artery bypass grafting surgery. Int J Cardiol. (2016) 221:977–86. doi: 10.1016/j.ijcard.2016.07.108
Shafiei E, Bahtoei M, Raj P, Ostovar A, Iranpour D, Akbarzadeh S, et al. Effects of N-acetyl cysteine and melatonin on early reperfusion injury in patients undergoing coronary artery bypass grafting: a randomized, open-labeled, placebo-controlled trial. Medicine (Baltimore). (2018) 97:e11383. doi: 10.1097/MD.0000000000011383
Haghjooy Javanmard S, Ziaei A, Ziaei S, Ziaei E, Mirmohammad-Sadeghi M. The effect of preoperative melatonin on nuclear erythroid 2-related factor 2 activation in patients undergoing coronary artery bypass grafting surgery. Oxid Med Cell Longev. (2013) 2013:676829. doi: 10.1155/2013/676829
Katherine A. Lyseng-Williamson (2012) Melatonin Prolonged Release. In the Treatment of Insomnia in Patients Aged ≥55 years. Drugs & Aging volume 29, pages 911–923 (2012) DOI: 10.1007/s40266-012-0018-z
Patrick Lemoine (2007). Prolonged-release melatonin improves sleep quality and morning alertness in insomnia patients aged 55 years and older and has no withdrawal effects. Randomized Controlled Trial. J Sleep Res 2007 Dec;16(4):372-80. doi: 10.1111/j.1365-2869.2007.00613.x.
Seithikurippu R. Pandi-Perumal (2007) Role of the Melatonin System in the Control of Sleep CNS Drugs volume 21, pages995–1018 (2007). DOI: 10.2165/00023210-200721120-00004
Dominguez-Rodriguez A. Melatonin in cardiovascular disease. Expert Opin Investig Drugs. (2012) 21:1593–6. doi: 10.1517/13543784.2012.716037
Tengattini S, Reiter RJ, Tan DX, Terron MP, Rodella LF, Rezzani R. (2008) Cardiovascular diseases: protective effects of melatonin. J Pineal Res. 2008 Jan;44(1):16-25. doi: 10.1111/j.1600-079X.2007.00518.x.
Frederic Nduhirabandi, Gerald J. Maarman. (2018). Melatonin in Heart Failure: A Promising Therapeutic Strategy? Molecules 2018 Jul 22;23(7):1819. doi: 10.3390/molecules23071819.
Steinhilber D, Brungs M, Werz O et al. The nuclear receptor for melatonin repress 5-lipoxygenase gene expression in human B lymphocytes. J Biol Chem 1995; 270: 7037– 7040.
Jacquie Baker,Kurt Kimpinski (2018). Role of melatonin in blood pressure regulation: An adjunct anti-hypertensive agent. CEPP Volume45, Issue8. https://doi.org/10.1111/1440-1681.12942
Ekmekcioglu C, Thalhammer T, Humpeler S, et al. The melatonin receptor subtype MT2 is present in the human cardiovascular system. J Pineal Res. 2003; 35: 40- 44.
Hardeland R, Madrid JA, Tand DX, Reiter RJ: Melatonin the circadian multioscillator system and health: the need for detailed analyses of peripheral melatonin signalling. J Pineal Res. 2011, 52:139-166. 10.1111/j.1600-079X.2011.00934.x
Zeman M, Dulkova K, Bada V, Herikova I.: Plasma melatonin concentrations in hypertensive with dipping and non-dipping blood pressure profile. Life Sci. 2005, 76:1795-1803. 10.1016/j.lfs.2004.08.034
Scheer FA, Van Motfrans GA, van Someren EJ, Mairuhu G, Buijs RM: Daily nighttime melatonin reduces blood pressure in male patients with essential hypertension. Hypertension. 2004, 43:192-197. 10.1161/01.HYP.0000113293.15186.3b
Borghi C, Cicero AF: Nutraceuticals with clinically detectable blood pressure lowering effect: a review of available randomized clinical trials and their meta-analyses. Br J Clin Pharmacol. 2017, 83:163-171. 10.1111/bcp.12902
Yıldız M, Akdemir O: Assessment of the effects of physiological release of melatonin on arterial distensibility and blood pressure. Cardiol Young. 2009, 19:198-203. 10.1017/S1047951109003692
Arangino S, Cagnacci A, Angiolucci M, et al.: Effects of melatonin on vascular reactivity, catecholamine levels, and blood pressure in healthy men. Am J Cardiol. 1999, 83:1417-1419. 10.1016/S0002-9149(99)00112-5
Rexhaj E, Pireva A, Paoloni-Giacobino A, et al.: Prevention of vascular dysfunction and arterial hypertension in mice generated by assisted reproductive technologies by addition of melatonin to culture media. Am J Physiol Heart Circ Physiol. 2015, 309:1151-1156. 10.1152/ajpheart.00621.2014
Lusardi P, Piazza E, Fogari R: Cardiovascular effects of melatonin in hypertensive patients well controlled by nifedipine: a 24-hour study. Br J Clin Pharmacol. 2000, 49:423-427. 10.1046/j.1365-2125.2000.00195.x
Satake N, Oe H, Shibata S: Vasorelaxing action of melatonin in rat isolated aorta: possible endothelium dependent relaxation. Gen Pharmacol. 1991, 22:1127-1133. 10.1016/0306-3623(91)90589-x
Flora Ozkalayci, Umut Kocabas, Betul U. Altun, Seithikurippu Pandi-Perumal, Armagan Altun (2021) Relationship Between Melatonin and Cardiovascular Disease. Cureus 2021 року;13(1):e12935. doi: 10.7759/cureus.12935.
Kozirog M, Poliwczak AR, Duchnowicz P, Koter Michalak M, Joanna S, Bronce M: Melatonin treatment improves blood pressure, lipid profile, and parameters of oxidative stress in patients with metabolic syndrome. J Pineal Res. 2011, 50:261-266. 10.1111/j.1600-079X.2010.00835.x
Tailleux A, Torpier G, Bonnefont-Rousselot D, et al.: Daily melatonin supplementation in mice increases atherosclerosis in proximal aorta. Biochem Biophys Res Commun. 2002, 293:1114-1123.10.1016/S0006-291X(02)00336-4
Celinski K, Konturek PC, Slomka M, et al.: Effects of treatment with melatonin and tryptophan on liver enzymes, parameters of fat metabolism and plasma levels of cytokines in patients with non-alcoholic fatty liver disease-14 months follow up. J Physiol Pharmacol. 2014, 65:75-82.
Angelo Cagnacci (2005) Prolonged melatonin administration decreases nocturnal blood pressure in women. Am J Hypertens 2005 Dec;18(12 Pt 1):1614-8. DOI: 10.1016/j.amjhyper.2005.05.008
Michael Jonas (2003) Impaired nocturnal melatonin secretion in non-dipper hypertensive patients. Blood Press 2003;12(1):19-24.
dos Santos GB, Rodrigues MJM, Gonçalves EM, Marcondes MCCG, Areas MA. Melatonin reduces oxidative stress and cardiovascular changes induced by stanozolol in rats exposed to swimming exercise. Eurasian J Med. 2013;45(3):155.
Reiter RJ. Pineal melatonin: cell biology of its synthesis and of its physiological interactions. Endocr Rev. 1991;12(2):151–80.
Zawilska JB, Skene DJ, Arendt J. Physiology and pharmacology of melatonin in relation to biological rhythms. Pharmacol Rep. 2009;61(3):383–410.
Pevet P. Melatonin: from seasonal to circadian signal. J Neuroendocrinol. 2003;15(4):422–6.
Afshin Rahbarghazi (2021). Role of melatonin in the angiogenesis potential; highlights on the cardiovascular disease. J Inflamm (Lond) 2021 Feb 2;18(1):4. doi: 10.1186/s12950-021-00269-5.
Ehud Grossman , Moshe Laudon (2006). Melatonin reduces night blood pressure in patients with nocturnal hypertension. Am J Med 2006 Oct;119(10):898-902. DOI: 10.1016/j.amjmed.2006.02.002
Alberto Domínguez-Rodríguez Pedro Abreu-González. Melatonin and Cardioprotection in Humans: A Systematic Review and Meta-Analysis of Randomized Controlled Trials (2021). Front. Cardiovasc. Med., 12 May 2021 https://doi.org/10.3389/fcvm.2021.635083
Kopustinskiene D. M., Bernatoniene J. Molecular mechanisms of melatonin-mediated cell protection and signaling in health and disease // Pharmaceutics. — 2021. — 13 (2). — P. 129. doi: 10.3390/pharmaceutics13020129
Swapna Bhaskar, D. Hemavathy (2016). Prevalence of chronic insomnia in adult patients and its correlation with medical comorbidities. J Family Med Prim Care. 2016 Oct-Dec; 5(4): 780–784. doi: 10.4103/2249-4863.201153
Taylor DJ, Mallory LJ, Lichstein KL, Durrence HH, Riedel BW, Bush AJ. Comorbidity of chronic insomnia with medical problems. Sleep. 2007;30:213–8.
Suzanne M Bertisch (2018). Insomnia with objective short sleep duration and risk of incident cardiovascular disease and all-cause mortality: Sleep Heart Health Study. Sleep. 2018 Jun; 41(6): zsy047. doi: 10.1093/sleep/zsy047
Francesco Sofi. (2014). Insomnia and risk of cardiovascular disease: a meta-analysis. Eur J Prev Cardiol 2014 Jan;21(1):57-64.doi: 10.1177/2047487312460020.
Cappuccio FP, Stranges S, Kandala N-B, Miller MA, Taggart FM, Kumari M, et al. Gender-specific associations of short sleep duration with prevalent and incident hypertension: the Whitehall II Study. Hypertension. 2007;50:693–700. Aggarwal B, Makarem N, Shah R, Emin M, Wei Y, St-Onge M-P, et al.
Effects of inadequate sleep on blood pressure and endothelial inflammation in women: findings from the American Heart Association Go Red for Women Strategically Focused Research Network. J Am Heart Assoc. 2018 doi: 10.1161/JAHA.118.008590.
Kim JH, Hayek SS, Ko Y-A, Liu C, Samman Tahhan A, Ali S, et al. Sleep duration and mortality in patients with coronary artery disease. Am J Cardiol. 2019;123:874–881.
Xiao Q, Keadle SK, Hollenbeck AR, Matthews CE. Sleep duration and total and cause-specific mortality in a large US cohort: interrelationships with physical activity, sedentary behavior, and body mass index. Am J Epidemiol. 2014;180:997–1006.
Cappuccio FP, D’Elia L, Strazzullo P, Miller MA. Sleep duration and all-cause mortality: a systematic review and meta-analysis of prospective studies. Sleep. 2010;33:585–592.
Rita Del Pinto, Guido Grassi (2021). Diagnostic and Therapeutic Approach to Sleep Disorders, High Blood Pressure and Cardiovascular Diseases: A Consensus Document by the Italian Society of Hypertension (SIIA). High Blood Press Cardiovasc Prev. 2021; 28(2): 85–102. doi: 10.1007/s40292-021-00436-y
Ohayon MM, Smirne S. Prevalence and consequences of insomnia disorders in the general population of Italy. Sleep Med. 2002;3:115–120.
St-Onge M-P, Grandner MA, Brown D, Conroy MB, Jean-Louis G, Coons M, et al. Sleep duration and quality: impact on lifestyle behaviors and cardiometabolic health: a scientific statement from the American Heart Association. Circulation. 2016;134:e367–e386.
Hertenstein E, Feige B, Gmeiner T, Kienzler C, Spiegelhalder K, Johann A, et al. Insomnia as a predictor of mental disorders: a systematic review and meta-analysis. Sleep Med Rev. 2019;43:96–105.
Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39:3021–3104.
Cappuccio FP, Stranges S, Kandala N-B, Miller MA, Taggart FM, Kumari M, et al. Gender-specific associations of short sleep duration with prevalent and incident hypertension: the Whitehall II Study. Hypertension. 2007;50:693–700.
Aggarwal B, Makarem N, Shah R, Emin M, Wei Y, St-Onge M-P, et al. Effects of inadequate sleep on blood pressure and endothelial inflammation in women: findings from the American Heart Association Go Red for Women Strategically Focused Research Network. J Am Heart Assoc. 2018 doi: 10.1161/JAHA.118.008590.
Kim JH, Hayek SS, Ko Y-A, Liu C, Samman Tahhan A, Ali S, et al. Sleep duration and mortality in patients with coronary artery disease. Am J Cardiol. 2019;123:874–881.
Xiaoyu Li, Daniela Sotres-Alvarez, Linda C. Gallo (2021) Associations of Sleep-disordered Breathing and Insomnia with Incident Hypertension and Diabetes. The Hispanic Community Health Study/Study of Latinos. Am J Respir Crit Care Med. 2021 Feb 1; 203(3): 356–365. doi: 10.1164/rccm.201912-2330OC
Ovidiu C. Sergio S., Luciana A. (2019) Cardioprotective Melatonin: Translating from Proof-of-Concept Studies to Therapeutic Use. Int. J. Mol. Sci. 2019, 20(18), 4342; https://doi.org/10.3390/ijms20184342
Forman JP, Curhan GC, Schernhammer ES. Urinary melatonin and risk of incident hypertension among young women. J Hypertens. 2010;28:446–451.
Palagini L, Manni R, Aguglia E, Amore M, Brugnoli R, Girardi P, et al. Expert opinions and consensus recommendations for the evaluation and management of insomnia in clinical practice: Joint Statements of Five Italian Scientific Societies. Front Psychiatry. 2020;11:558.
Wilson S, Anderson K, Baldwin D, Dijk D-J, Espie A, Espie C, et al. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: an update. J Psychopharmacol. 2019;33:923–947.
Ohkubo T, Hozawa A, Nagai K, et al. Prediction of stroke by ambulatory blood pressure monitoring versus screening blood pressure measurements in a general population: the Ohasama study. J Hypertens. 2000;18(7):847–854.
Knutson KL, Van Cauter E, Rathouz PJ, et al. Association between sleep and blood pressure in midlife: the CARDIA sleep study. Arch Intern Med. 2009;169(11):1055–1061.
Phillips B, Bůzková P, Enright P. Cardiovascular Health Study Research Group Insomnia did not predict incident hypertension in older adults in the cardiovascular health study. Sleep. 2009;32(1):65–72.
Clay E., Falissard B., Moore N., Toumi M. Contribution of prolonged-release melatonin and anti-benzodiazepine campaigns
to the reduction of benzodiazepine and Z-drugs consumption in
nine European countries // Eur. J. Clin. Pharmacol. — 2013. — 69 (4). — P. 1 — 10. doi: 10.1007/s00228-012-1424-1
Zisapel N. New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation // Br. J. Pharmacol. — 2018. — 175 (16). — P. 3190—3199. doi: 10.1111/bph.14116.
Rodriguez-Rubio M. et al. A phase II, single-center, double-blind,
randomized placebo-controlled trial to explore the efficacy and
safety of intravenous melatonin in patients with COVID-19 admitted to the intensive care unit (MelCOVID study): A structured summary of a study protocol for a randomized controlled trial // Trials. — 2020. — 21. — P. 699 — 701. doi: 10.1186/s13063-020-04632-4.
Kripke DF, Garfinkel L, Wingard DL et al (2002) Mortality associated with sleep duration and insomnia. Arch Gen Psychiatry 59(2):131–136
Dieter Riemann,Chiara Baglioni (2017) European guideline for the diagnosis and treatment of insomnia. https://doi.org/10.1111/jsr.12594
Palagini L, Manni R, Aguglia E, Amore M, Brugnoli R, Girardi P, et al. Expert opinions and consensus recommendations for the evaluation and management of insomnia in clinical practice: Joint Statements of Five Italian Scientific Societies. Front Psychiatry. 2020;11:558.
Amir Qaseem (2016) Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians Clinical Guidelines19 July 2016 https://doi.org/10.7326/M15-2175
Nadia Ferlazzo, Giulia Andolina, Attilio Cannata (2020). Is Melatonin the Cornucopia of the 21st Century? Antioxidants (Basel) 2020 Nov 5;9(11):1088. doi: 10.3390/antiox9111088.
Karasek, M. Melatonin, human aging, and age-related diseases. Exp. Gerontol. 2004, 39, 1723–1729.
Scholtens, R.M.; van Munster, B.C.; van Kempen, M.F.; de Rooij, S.E. Physiological melatonin levels in healthy older people: A systematic review. J. Psychosom. Res. 2016, 86, 20–27
Baker J., Kimpinski K. Role of melatonin in blood pressure regulation: An adjunct anti-hypertensive agent // Clinical and Experimental Pharmacology and Physiology. — 2018. — 45 (8). — P. 755 — 766. doi: 10.1111/1440-1681.12942
EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). Scientific Opinion on the evaluation of allergenic foods and food
ingredients for labelling purposes // EFSA Journal. — 2014. — 12 (11). — P.
Reiter RJ, Tan DX, Rosales-Corral S, Galano A, Zhou XJ, Xu B. Mitochondria: central organelles for melatonin's antioxidant and anti-aging actions. Molecules. 2018;23:E509. https://doi.org/10.3390/molecules23020509
Simko F, Baka T, Paulis L, Reiter RJ. Elevated heart rate and nondipping heart rate as potential targets for melatonin: a review. J Pineal Res. 2016;61:127–37.
Simko F, Pechanova O. Remodelling of the heart and vessels in experimental hypertension: advances in protection. J Hypertens. 2010;28(Suppl 1):S1–6.
Patrick Lemoine, Alan G Wade, Amnon Katz, Tali Nir, Nava Zisapel (2012) Efficacy and safety of prolonged-release melatonin for insomnia in middle-aged and elderly patients with hypertension: a combined analysis of controlled clinical trials. Integr Blood Press Control. 2012; 5: 9–17. doi: 10.2147/IBPC.S27240
Roth T. Insomnia: definition, prevalence, etiology, and consequences. J Clin Sleep Med. 2007;3(Suppl 5):S7–10.
Leger D, Poursain B, Neubauer D, Uchiyama M. An international survey of sleeping problems in the general population. Curr Med Res Opin. 2008;24(1):307–317.
Gangwisch JE, Malaspina D, Posner K, et al. Insomnia and sleep duration as mediators of the relationship between depression and hypertension incidence. Am J Hypertens. 2010;23(1):62–69.
Gangwisch JE, Heymsfield SB, Boden-Albala B, et al. Short sleep duration as a risk factor for hypertension: analyses of the first National Health and Nutrition Examination Survey. Hypertension. 2006 May;47(5):833–839.
Fung MM, Peters K, Redline S, et al. Decreased slow wave sleep increases risk of developing hypertension in elderly men. Hypertension. 2011;58(4):596–603.
Hermida RC, Ayala DE, Mojon A, Fernandez JR. Decreasing sleep-time blood pressure determined by ambulatory monitoring reduces cardiovascular risk. J Am Coll Cardiol. 2011;58(11):1165–1173.
Ehud Grossman, Moshe Laudon, Nava Zisapel (2011) Effect of melatonin on nocturnal blood pressure: meta-analysis of randomized controlled trials. Vasc Health Risk Manag 2011;7:577-84. doi: 10.2147/VHRM.S24603
Andersen LP, Gögenur I, Rosenberg J, Reiter RJ. The Safety of Melatonin in Humans. Clin Drug Investig. 2016 Mar;36(3):169-75.
Neubauer DN. A review of ramelteon in the treatment of sleep disorders. Neuropsychiatr Dis Treat. 2008 Feb;4(1):69-79.
Neubauer DN. Tasimelteon for the treatment of non-24-hour sleep-wake disorder. Drugs Today (Barc). 2015 Jan;51(1):29-35.
Erland LA, Saxena PK. Melatonin Natural Health Products and Supplements: Presence of Serotonin and Significant Variability of Melatonin Content. J Clin Sleep Med. 2017 Feb 15;13(2):275-281.
EUROPEAN MEDICINES AGENCY DECISION https://www.ema.europa.eu/en/documents/overview/circadin-epar-summary-public_en.pdf
Wilson S, Anderson K, Baldwin D, et al. British association for psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: an update. J Psychopharmacol. 2019;33(8):923–947. doi:10.1177/0269881119855343
Palagini L, Manni R, Aguglia E, et al. Expert opinions and consensus recommendations for the evaluation and management of insomnia in clinical practice: joint statements of five Italian scientific societies. Front Psychiatry. 2020;11:558. doi:10.3389/fpsyt.2020.00558
Satake N, Oe H, Shibata S. Vasorelaxing action of melatonin in rat isolated aorta; possible endothelium dependent relaxation. Gen Pharmacol. 1991;22:1127-1133.
Doolen S, Krause DN, Dubocovich ML, Duckles SP. Melatonin mediates two distinct responses in vascular smooth muscle. Eur J Pharmacol. 1998;345:67-69.
Reiter RJ, Tan D-X, Manchester LC, Lopez-Burillo S, Sainz RM, Mayo JC. Melatonin: detoxification of oxygen and nitrogen-based toxic reactants. Adv Exp Med Biol. 2003;527:539-548.
Anwar MM, Meki A-RM, Abu Rahma HH. Inhibitory effects of melatonin on vascular reactivity: possible role of vasoactive mediators. Comp Biochem Physiol Part C 2001;130:357-367.
Koziróg M, Poliwczak AR, Duchnowicz P, Koter-Michalak M, Sikora J, Broncel M. Melatonin treatment improves blood pressure, lipid profile, and parameters of oxidative stress in patients with metabolic syndrome. J Pineal Res. 2011;50:261-266.
Nishiyama K, Yasue H, Moriyama Y, et al. Acute effects of melatonin administration on cardiovascular autonomic regulation in healthy men. Am Heart J. 2001;141:E9.
Rechciński T, Trzos E, Wierzbowska-Drabik K, Krzemińska-Pakuła M, Kurpesa M. Melatonin for nondippers with coronary artery disease: assessment of blood pressure profile and heart rate variability. Hypertens Res. 2010;33:56-61.
Nishiyama K, Yasue H, Moriyama Y, et al. Acute effects of melatonin administration on cardiovascular autonomic regulation in healthy men. Am Heart J. 2001;141:E9.
Rahman, S.A., Wright, K.P., Lockley, S.W. et al. Characterizing the temporal Dynamics of Melatonin and Cortisol Changes in Response to Nocturnal Light Exposure. Sci Rep 9, 19720 (2019). https://doi.org/10.1038/s41598-019-54806-7
Zetner D., Andersen L. P. H., Rosenberg J. Pharmacokinetics of alternative administration routes of melatonin: a systematic review // Drug Res. — 2016. — 66 (4). — P. 169 — 173.
R L DeMuro 1, A N Nafziger, D E Blask, A M Menhinick, J S Bertino Jr (2000) The absolute bioavailability of oral melatoninJ Clin Pharmacol 2000 Jul;40(7):781-4. doi: 10.1177/00912700022009422.
F I Komarov, L F Goncharov, Z F Goncharova, L A Makarova (1998) Comparative study of the effectiveness of Cozaar monotherapy and Cozaar and melatonin combined therapy in aged patients with hypertension Klin Med (Mosk). 1998;76(12):49-5